新型癌症治疗方法可以瞄准离子通道
尽管妇科癌症是女性中最致命的癌症之一,但对这些癌症晚期的治疗非常稀缺。伊利诺斯大学癌症中心的Saverio Gentile博士一直在研究钾离子通道作为新型癌症治疗的潜在靶点。他发现钾通道激活剂的使用极大地降低了细胞的运动性、肿瘤的生长和癌细胞的干性,减缓了癌症的发展。此外,fda批准的米诺地尔等药物已经针对钾离子通道。因此,它们可以被重新用于新的、安全的妇科癌症治疗,既低成本又容易获得。
妇科癌症,女性生殖道中癌细胞的不受控制的生长和传播,是女性最致死的癌症之一。虽然这些癌症,包括子宫内膜,宫颈和卵巢癌,是全世界死亡的主要原因,但它们被研究。寻找这些癌症的高级阶段的治疗仍然是一个挑战。为了克服这种缺乏先进的阶段治疗,伊利诺伊大学癌症中心的Saverio Genile博士一直研究了新型癌症治疗方法的新潜在目标:离子通道。
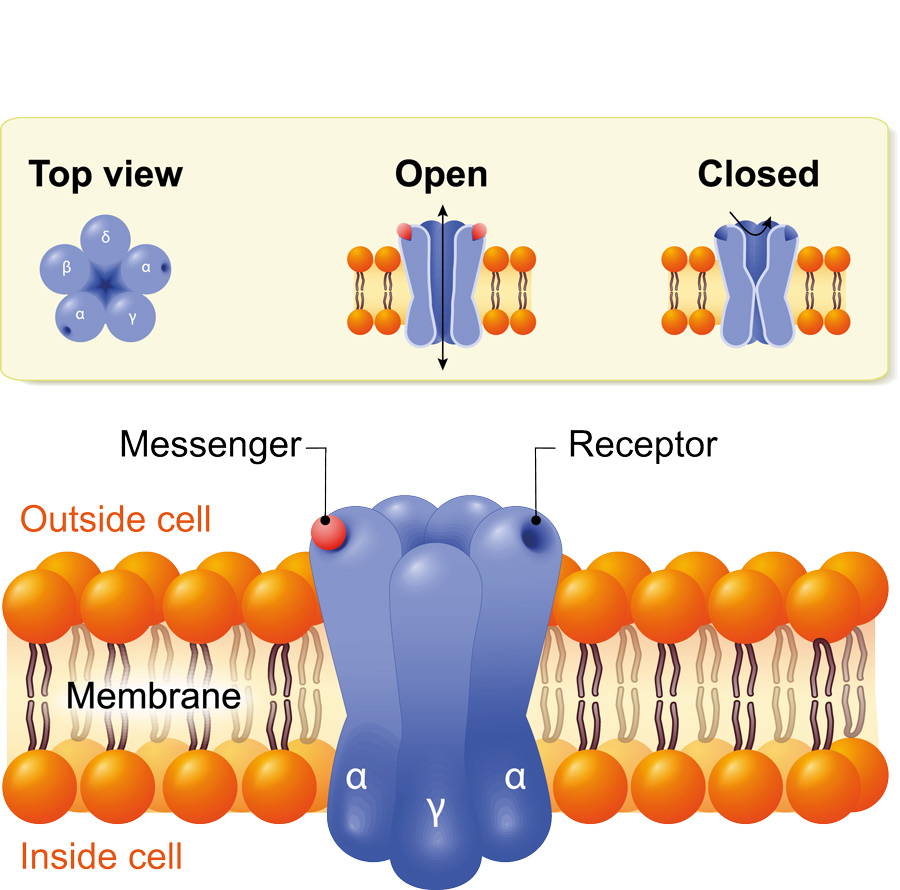
离子通道是一种嵌在细胞膜上的蛋白质。它们是离子、带电原子或分子进入和离开细胞的选择性通道。离子通道存在于所有细胞的细胞膜中,在神经传递、肌肉收缩和胰岛素分泌等生物过程中发挥着重要作用。然而,尽管它们在大脑和心脏疾病方面已经被广泛研究,但它们在癌症生物学中的作用尚不清楚。

Gentile博士的研究重点在于阐明钾离子通道在妇科和乳腺癌生物学中的作用。他的目标是开发一种以钾离子通道为靶点的药理学策略来治疗癌症。
钾通道的作用
钾离子通道对调节细胞运动性至关重要,使用能量的细胞运动。获取动力在癌症的转移中是必不可少的(即癌细胞从身体的一部分到另一个部位形成新肿瘤)。具体地,钾通道调节电池从上皮状态切换的能力,其中它们被粘附在一起并粘附在基底膜上,以称为间充质状态,其中它们失去这种粘附性。这使癌细胞增强了迁移和侵入性能力。由于各种癌症异常表达某些钾通道,因此表明它们可能是癌症生物学中的关键因素。
靶向这些通道并影响其功能的药物具有阻止肿瘤生长和转移的潜力。
通过靶向活化或抑制钾,钠,钙或氯离子通道,11种不同的癌症类型显示细胞增殖降低。
在进一步调查后,Gentile博士发现这些通道在控制癌症的一些关键特征方面起着关键作用。这包括癌细胞的增殖和生长,癌细胞的转移和癌细胞的存活。因此,靶向这些通道并影响其功能的药物有可能阻止肿瘤的生长和转移,有效地阻止癌症的发展。
重新培养现有的药物
一种这样的钾通道,Kir6 / sur通道,由kir6.1或Kir6.2蛋白的四个亚基组成,所述蛋白质与受体结合在一起,SUR1或SUR2。KIR6 / SUR频道已经是几种现有的FDA批准的药物,包括Glibenclamide,抗糖尿病药物,靶向Kir6.1 / Sur1通道,抗高血血症的抗糖尿病药物,靶向Kir6.2/ sur2通道。不同Kir6亚基的表达与SUR1或SUR2受体授予药物组织特异性,这意味着靶向KIR6.2 / SUR2的药物不会影响KIR6.1 / SUR1通道的组织,有效地消除任何副作用。
已经发现妇科癌细胞表达Kir6.2/SUR2,因此可以被米诺地尔靶向,激活该通道。Gentile博士发现,使用米诺地尔治疗卵巢癌,通过线粒体破坏和广泛的DNA损伤来改变细胞的代谢状态,从而阻止了肿瘤的生长。因此,米诺地尔激活了一个细胞死亡途径,从而大大减少了肿瘤的生长。在子宫内膜癌细胞中也可以看到同样的效果。
KIR6.2 / SUR2通道提供的组织特异性意味着即使高剂量也没有诱导任何副作用。这克服了剂量限制毒性的问题,这些毒性伴有妇科癌症的当前治疗,这一切都会增加发病率并限制提供最佳治疗剂量的能力。

令人兴奋的是,这些发现表明,重新利用现有的钾通道激活剂可能代表一种新的、最重要的、安全的治疗妇科癌症的方法,既低成本又容易获得。由于米诺地尔也已经获得了fda的批准,因此它有可能从实验室快速过渡到临床。
战斗乳房癌症
钾离子通道不仅在妇科癌症中起关键作用。Gentile博士还探索了它们在乳腺癌生物学中的作用。
在乳腺癌中,临床结果受与雌激素依赖信信号和HER2信号通路相关的蛋白质表达的严重影响。靶向这些信号传导途径中的任何一种的治疗剂对患有雌激素受体阳性或HER2过表达癌症的患者的患者的存活率改善了,但对称为三重阴性乳腺癌的患者无效,这既不使用这些信号传导途径。

然而,对钾通道Kv11.1编码的基因的高水平表达与雌激素受体阴性乳腺癌的良好预后有关。在癌症的早期阶段,KV11.1的表达与过渡到间充质状态相关,允许细胞迁移。因此,KV11.1活性的不受控制的增益或损失与肿瘤进展相关联。
外邦人博士研究了激活KV11.1通道对癌症发育的影响,发现它显着降低了肿瘤的转移扩散。使用称为NS1643的KV11.1活化剂分子通过防止从上皮细胞到间充质状态而抑制细胞活性,从而阻止细胞迁移和侵入其他组织。还发现它可以减少癌细胞的“茎干”,这是细胞使它们的谱系延伸并区分为不同细胞类型的能力。
通过靶向活化或抑制钾,钠,钙或氯离子通道,11种不同的癌症类型显示细胞增殖降低。
NS1643通过抑制称为β-catenin的分子的功能,这在细胞运动中起着重要作用。当细胞粘附在一起并移动到细胞核时,在细胞膜中发现并通过激活信号通路来刺激细胞迁移。NS1643抑制β-连环蛋白的降解并促进其定位对细胞膜,防止细胞迁移。值得注意的是,KV11.1通道未在正常,健康的乳房细胞中表达,因此NS1643的使用是针对癌细胞的选择性。重要的是,这些类型的药物不会改变心脏能表明,表明潜在的治疗方法是有效和安全的。
还发现NS1643在细胞周期的一个相中不可逆转地停止癌细胞,防止它们复制。这种细胞周期的阻止增加了与衰老相关的细胞中蛋白质水平,其中细胞因子由于DNA损伤等应力因子而停止分割的状态。然而,衰老也被认为是一种天然的抗肿瘤机制,因此在癌细胞中诱导这种状态可防止肿瘤增殖。另外,衰老细胞更容易受到传统化疗药物的影响。因此,活化钾通道本身可以作为抗癌治疗,但也可以作为佐剂治疗,使传统化疗更有效。
不仅仅是钾
虽然钾离子通道一直是Gentile博士最近研究的重点,但他也通过回顾类似的研究文献指出,针对其他离子的通道也可能对其他类型的癌症有治疗效果。例如,使用像米贝法拉地尔这样的小分子抑制剂抑制钙离子通道,已经发现通过诱导细胞死亡来减少前列腺癌中的细胞增殖,当氯离子通道被称为蟾二烯内酯的激活剂靶向时,在神经胶质瘤中也看到了类似的结果。总共有11种不同类型的癌症通过靶向激活或抑制钾、钠、钙或氯离子通道显示细胞增殖减少。
在可用性方面仍然严重缺乏治疗前期妇科和三重阴性乳腺癌的治疗,钾通道可以提出癌症治疗剂的新靶标。重新施加现有的钾通道激活剂有可能提供新的,安全有效的抗癌药理学策略,并提高当前化疗治疗的疗效。
个人反应
将米诺地尔等药物正式用于新的癌症治疗的下一步是什么?
下一步是通过临床试验来测试Minoxidil的影响。我们已经为此准备了必要的步骤。我们也有兴趣测试我们的方法是否可以提高目前使用的治疗剂的抗癌效果并降低毒性。

